artiklar och sammanfattningar om vetenskapen bakom vår verksamhet, med trovärdiga källor
Ett stort antal vetenskapliga studier visar tydliga samband mellan ett högt fiberintag och god hälsa över tid. Forskning kopplar en fiberrik kost till minskad risk för hjärt-kärlsjukdom och förbättrad metabol hälsa, samt till faktorer som är förknippade med ett längre och friskare liv.
En viktig förklaring är att kostfibrer fungerar som näring för tarmens goda bakterier. När dessa bryter ner fibrer bildas kortkedjiga fettsyror (SCFA), som spelar en central roll för cellernas energibildning, tarmbarriär, immunbalans och att minska låggradig inflammation.
SCFA har i forskning kopplats till:
Eftersom olika fibrer gynnar olika bakterier är variation avgörande. En bred fiberprofil ger tarmfloran bättre förutsättningar – och kroppen ett starkare fundament för långsiktig hälsa.
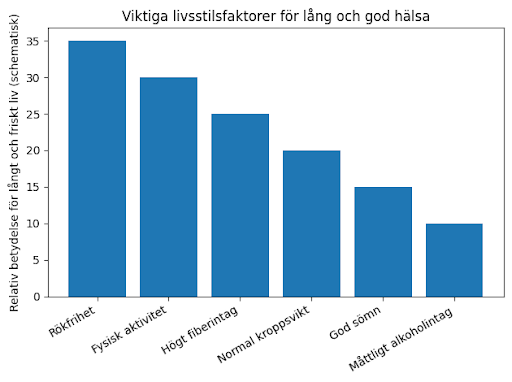
Kostfiber – den viktigaste kostfaktorn för ett långt och friskt liv
Stora vetenskapliga sammanställningar visar att ett högt fiberintag är starkt kopplat till bättre hälsa och längre livslängd. En omfattande analys publicerad i The Lancet visade att personer med ett högt fiberintag hade 15–30 % lägre total mortalitet, samt lägre risk för hjärt-kärlsjukdom, typ-2-diabetes och kolorektalcancer. Detta motsvarade i genomsnitt cirka 3 extra levnadsår jämfört med personer med lågt fiberintag. Effekten ökade linjärt upp till omkring 25–30 gram fiber per dag, med ytterligare hälsovinster vid ännu högre intag.
(Reynolds et al., The Lancet, 2019)
Hälsovinster vid högre fiberintag (över 30 g per dag)
Forskning visar att hälsofördelarna med kostfiber fortsätter även vid intag över 30 gram per dag, särskilt när fibrerna kommer från en varierad kost. För både vardagsaktiva och idrottare kan ett högre fiberintag bidra till bättre funktion i flera av kroppens grundläggande system.
För alla som vill må bra i vardagen
Ett högre fiberintag är kopplat till fortsatt förbättrad hjärt-kärlhälsa, stabilare blodsocker och lägre nivåer av låggradig inflammation. Det stödjer en välfungerande tarm, gynnar en rikare tarmflora och kan bidra till bättre metabol balans och fler friska år.
För fysiskt aktiva och idrottare
För den som tränar regelbundet kan högre fiberintag bidra till jämnare energitillgång, förbättrad insulinkänslighet och effektivare återhämtning mellan träningspass. En stark tarmbarriär och ökad produktion av kortkedjiga fettsyror kan även stödja immunförsvaret och kroppens förmåga att hantera hög belastning över tid.
Oavsett aktivitetsnivå tyder forskningen på att fördelarna med kostfiber inte planar ut vid 30 gram per dag. En bred variation av fibrer kan fortsätta att stärka tarmflora, minska inflammation och bidra till både bättre livskvalitet och långsiktig hälsa.
Reynolds, Andrew et al. Carbohydrate quality and human health: a series of systematic reviews and meta-analyses The Lancet, Volume 393, Issue 10170, 434 – 445
Se hela artikeln: https://www.thelancet.com/article/S0140-6736(18)31809-9/fulltext
En omfattande analys av över 1 300 studier visar tydliga samband mellan kostfiber, hälsa och livslängd. Forskningen bekräftar att en fiberrik kost minskar risken för hjärt-kärlsjukdomar, vissa cancerformer och bidrar till ett längre liv. Starkast är kopplingarna till hjärthälsa, kranskärlssjukdom samt cancer i bukspottkörteln och magen.
Men varför är fibrer så viktiga? De fungerar som mat för tarmens goda bakterier, som i sin tur producerar kortkedjiga fettsyror (SCFA, short-chain fatty acids).
Dessa fettsyror:
Varje typ av fiber stödjer olika bakteriestammar, vilket gör en varierad och fiberrik kost avgörande för en hälsosam tarmflora. Vill du stärka din hälsa på riktigt? Se till att få i dig en bred variation av fibrer och låt vetenskapen guida dig mot en friskare framtid!
Våra fiberprodukter Raw Fiber, Green fiber och Yellow Fiber är sammansatta för att ge en stor variation av kostfibrer som ett tillägg till en varierad kost med mycket grönsaker och rotfrukter efter säsong.
Litteratur:
Veronese N et al: Dietary fiber and health outcomes: An umbrella review of systematic reviews and meta-analyses. The American Journal of Clinical Nutrition, Volume 107, Issue 3, 2018.
Länk till artikeln: https://pubmed.ncbi.nlm.nih.gov/29566200/
Trompette A et al: Dietary Fiber Confers Protection against Flu by Shaping Ly6c- Patrolling Monocyte Hematopoiesis and CD8+ T Cell Metabolism. Immunity, 2018.
Länk till artikeln: https://pubmed.ncbi.nlm.nih.gov/29768180/
Har du någonsin undrat varför du plötsligt blir sugen på något sött? Svaret kan ligga i din tarmflora – både som boven och lösningen!
Tarmbakterier styr ditt sötsug
I magen lever miljarder bakterier som inte bara hjälper till att bryta ner maten och stärka immunförsvaret, utan också påverkar vad vi är sugna på att äta. En av de mest intressanta bakterierna i det här sammanhanget är Bacteroides vulgaris.
Denna smarta lilla bakterie hjälper kroppen att reglera sötsug genom att aktivera en speciell ”broms” i tarmen – en receptor som kallas FFAR4. När FFAR4 aktiveras skickas signaler till hjärnan som minskar suget efter socker och gör att du känner dig nöjd längre.
Hur fibrer hjälper till att kontrollera sötsuget
Fibrer är nyckeln! De fungerar som näring för de goda tarmbakterierna, inklusive Bacteroides vulgaris. När du äter mer fibrer kan dessa bakterier producera viktiga ämnen, såsom vitamin B5 (pantotensyra), vilket i sin tur aktiverar FFAR4-receptorn.
När denna process startar händer flera positiva saker:
Mer GLP-1: Ett mättnadshormon frisätts, vilket gör att du känner dig mätt längre.
Mer FGF21: Ett leverhormon som signalerar till hjärnan att minska sötsuget.
Mindre sug efter snabba kolhydrater och socker!
Se artikeln: Zhang, T., Wang, W., Li, J. et al. Free fatty acid receptor 4 modulates dietary sugar preference via the gut microbiota. Nat Microbiol 10, 348–361 (2025). https://doi.org/10.1038/s41564-024-01902-8
Länk till artikeln: https://www.nature.com/articles/s41564-024-01902-8
Kostfibrer spelar en central roll i regleringen av kroppsvikt genom flera samverkande mekanismer. Våra fiberprodukter – Raw Fiber, Green Fiber och Yellow Fiber – är framtagna för att stödja viktminskning på ett fysiologiskt hållbart sätt genom påverkan på mättnad, blodsockerreglering, tarmflora och låggradig inflammation.
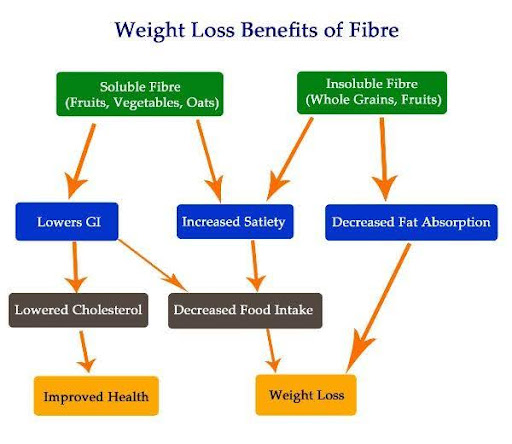
Lösliga och olösliga fibrer av olika slag förbättrar glukostoleransen, ökar mättnaden, minskar fettupptaget vilket leder till bättre hälsa och på sikt viktminskning. (Bild opportunityfitness.com.au)
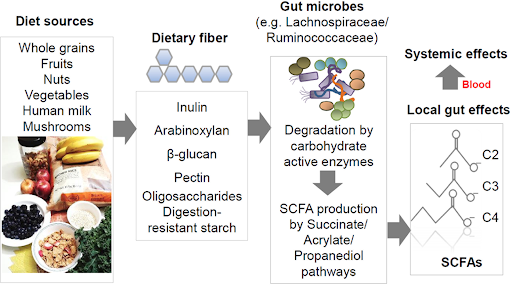
Figur 2. Olika typer av kostfibrer och hur de påverkar tarmfloran och ger både lokala effekter i tarmen och systemeffekter i kroppen. Kortkedjiga fettsyror (SCFA), såsom acetat (C2), propionat (C3) och butyrat (C4), bildas när kostfibrer och resistent stärkelse fermenteras av tarmens kommensala bakterier. Dessa bakterier har enzymer som bryter ned komplexa kolhydrater och driver SCFA-bildande metabola vägar. Ett fiberrikt kostintag gynnar tillväxten av SCFA-producerande bakterier. Fullkorn är rika på inulin, arabinoxylan och β-glukan, frukt är en viktig källa till pektin, och bröstmjölk innehåller oligosackarider som stimulerar SCFA-produktion hos spädbarn. Även resistent stärkelse når kolon och fermenteras. Lågt fiberintag, vilket är vanligt i vissa grupper i västvärlden, kan leda till brist på SCFA med nedsatt immunreglering som följd. SCFA verkar lokalt i tarmen men kan även ha systemiska effekter efter transport via portacirkulationen. (Kim, C.H. Control of lymphocyte functions by gut microbiota-derived short-chain fatty acids. Cell Mol Immunol 18, 1161–1171 (2021). https://doi.org/10.1038/s41423-020-00625-0) Observera att våra fiberprodukter skall kombineras med en antiinflammatorisk kost rik på frukt och grönsaker samt fibrer.
Fibrer ökar volymen i mag–tarmkanalen och fördröjer magsäckstömningen, vilket bidrar till ökad mättnad och minskat spontant energiintag. Detta kan underlätta kaloriunderskott utan att hunger och sug dominerar, vilket är avgörande för långsiktig viktminskning.
Genom att bromsa upptaget av kolhydrater bidrar fibrer till jämnare blodsockernivåer och minskade insulinpåslag. Detta är särskilt relevant vid viktminskning, då svängningar i blodsocker och insulin kan driva hunger, fettinlagring och energidippar.
Fermenterbara fibrer fungerar som näring för tarmens mikrobiota och leder till bildning av kortkedjiga fettsyror (SCFA), såsom butyrat. Dessa metaboliter har visats påverka energibalans, fettförbränning och inflammationsgrad, samt bidra till förbättrad metabol hälsa – faktorer som är nära kopplade till kroppsvikt.
Våra tre fiberprodukter ger möjlighet till individualisering:
För bästa tolerans och effekt rekommenderas alltid långsam upptrappning, särskilt hos personer med känslig mage eller tidigare låg fiberexponering.
Fiberprodukter är inte en genväg till viktminskning, men de kan vara ett värdefullt komplement till en balanserad kost och hälsosam livsstil. Genom att stödja mättnad, tarmhälsa och metabol balans kan fibrer bidra till att göra viktminskning mer långsiktig och biologiskt förankrad.
För bästa effekt vid viktminskning rekommenderas att fiberprodukterna används som ett stöd till mättnad, blodsockerstabilitet och tarmhälsa, snarare än som en isolerad åtgärd.
För att undvika mag–tarmbesvär och förbättra toleransen:
En långsam upptrappning minskar risken för gasbildning, uppblåsthet och obehag, särskilt hos personer med låg fiberkonsumtion eller känslig mage.
Vid obehag:
Fibrer bidrar till viktreglering genom flera biologiskt välunderbyggda mekanismer. De ökar mättnad genom att påverka magsäckstömning och tarmhormoner såsom GLP-1 och PYY¹. Fermenterbara fibrer påverkar dessutom tarmfloran och leder till produktion av kortkedjiga fettsyror (SCFA), vilka har visats modulera energibalans, fettinlagring och låggradig inflammation²³.
Epidemiologiska studier visar att högre fiberintag är associerat med lägre kroppsvikt och minskad risk för metabol sjukdom⁴. Randomiserade interventionsstudier stödjer att fiberintag kan underlätta viktminskning även utan strikt kaloriräkning, främst genom förbättrad mättnadsreglering⁵.
Metaboliter från kostfibrer (DF), som produceras av normala (kommensala) tarmbakterier, spelar en avgörande roll för att upprätthålla balansen i immunförsvaret. Kostfibrer, som tidigare betraktades som icke-essentiella näringsämnen, anses idag vara nödvändiga för att bibehålla en adekvat immunfunktion samt för att dämpa inflammatoriska och allergiska reaktioner.
Kortkedjiga fettsyror (SCFA), såsom acetat (ättiksyra), propionat (propionsyra) och butyrat (smörsyra), är de viktigaste metaboliterna från kostfibrer och produceras huvudsakligen av specialiserade kommensala bakterier som kan bryta ned kostfibrer till enklare sackarider och därefter metabolisera dessa till SCFA. SCFA verkar på många olika celltyper och reglerar flera centrala biologiska processer, inklusive värdens metabolism, tarmfunktion och immunsystemets aktivitet.
Denna översikt belyser särskilt de immunreglerande funktionerna hos kostfibrer och SCFA, med fokus på centrala medfödda och adaptiva lymfocyter. Aktuell kunskap om hur SCFA reglerar medfödda lymfoida celler, T-hjälparceller, cytotoxiska T-celler och B-celler samt hur dessa effekter påverkar immunitet, inflammation och allergiska reaktioner diskuteras. Se hela studien i Chang kims artikel, referens nedan.

Figur 1. Olika typer av kostfibrer och hur de påverkar tarmfloran och ger både lokala effekter i tarmen och systemeffekter i kroppen.
Kortkedjiga fettsyror (SCFA), såsom acetat (C2), propionat (C3) och butyrat (C4), bildas när kostfibrer och resistent stärkelse fermenteras av tarmens kommensala bakterier. Dessa bakterier har enzymer som bryter ned komplexa kolhydrater och driver SCFA-bildande metabola vägar. Ett fiberrikt kostintag gynnar tillväxten av SCFA-producerande bakterier. Fullkorn är rika på inulin, arabinoxylan och β-glukan, frukt är en viktig källa till pektin, och bröstmjölk innehåller oligosackarider som stimulerar SCFA-produktion hos spädbarn. Även resistent stärkelse når kolon och fermenteras. Lågt fiberintag, vilket är vanligt i vissa grupper i västvärlden, kan leda till brist på SCFA med nedsatt immunreglering som följd. SCFA verkar lokalt i tarmen men kan även ha systemiska effekter efter transport via portacirkulationen. (Kim, C.H. Control of lymphocyte functions by gut microbiota-derived short-chain fatty acids. Cell Mol Immunol 18, 1161–1171 (2021). https://doi.org/10.1038/s41423-020-00625-0) Observera att våra fiberprodukter skall kombineras med en antiinflammatorisk kost rik på frukt och grönsaker samt fibrer.
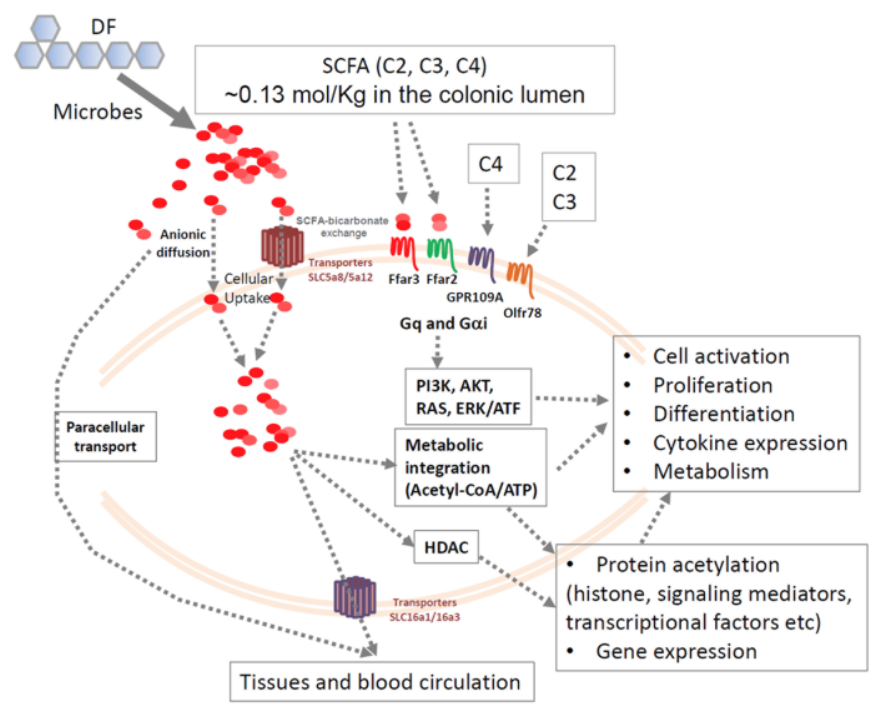
Figur 2. Transport, G-proteinkopplade receptorer och intracellulära funktioner hos SCFA.
Kortkedjiga fettsyror (SCFA) transporteras in i kolonocyter och andra vävnader via flera specifika transportörer samt genom paracellulär transport. Intracellulära SCFA utnyttjas lokalt i kolonocyterna, medan en del vidaretransporteras till blodcirkulationen.
SCFA aktiverar även G-proteinkopplade receptorer på cellytan, såsom Ffar2, Ffar3, GPR109A och Olfr78, vilket leder till aktivering av signalvägar som PI3K-, AKT-, RAS- och ERK1/2-vägarna. Dessa signaler samverkar och förstärker cytokinsignalering, vilket inducerar cellaktivering och proliferation.
SCFA, särskilt propionat (C3) och butyrat (C4), fungerar som effektiva hämmare av histondeacetylaser (HDAC) och inducerar proteinacetylering, vilket reglerar cellaktivering och genuttryck. SCFA omvandlas dessutom lätt till acetyl-CoA, som driver citronsyracykeln (TCA-cykeln) för produktion av ATP och metabola byggstenar samt ytterligare stödjer proteinacetylering.
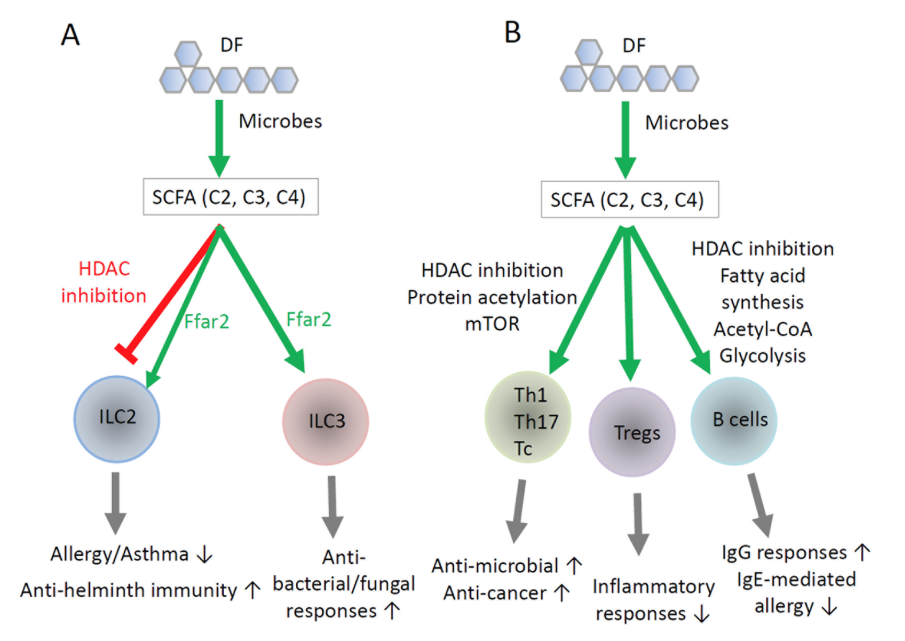
Figur 3. Direkt reglering av ILC, T-celler och B-celler av SCFA.
Kortkedjiga fettsyror (SCFA) reglerar medfödda lymfoida celler (ILC) på ett differentierat sätt. Generellt ökar SCFA aktiviteten hos ILC3, medan de hämmar ILC2. Signalering via Ffar2 (GPR43) i ILC2 och ILC3 aktiverar PI3K-, AKT- och mTOR-vägarna, vilket främjar cellproliferation och aktivering. Effekterna av SCFA och GPR43 är dock inte identiska: medan Ffar2-signalering ökar aktiviteten hos både ILC2 och ILC3, förstärker SCFA främst ILC3-funktionen samtidigt som ILC2 hämmas. Detta tyder på att receptorberoende signalering och SCFA:s intracellulära effekter har olika roller i regleringen av ILC2.
Kostfibrer och SCFA stödjer även funktionen hos T-hjälparceller, cytotoxiska T-celler, regulatoriska T-celler (Treg) och B-celler. En central effekt av SCFA är ökad proteinacetylering och förbättrad cellmetabolism i T- och B-celler, vilket påverkar differentieringen av naiva T-celler till Th1-, Th17- och Treg-celler. SCFA polariserar inte själva naiva T-celler, men fungerar som kostimulerande signaler tillsammans med cytokiner och T-cellsreceptoraktivering och förstärker därigenom utvecklingen av effektor-Th1- och Th17-celler. I en TGF-β-rik miljö under homeostas, såsom i tarmen, inducerar SCFA bildning av IL-10-producerande Treg.
SCFA förstärker även CD8-T-cellers effektorfunktion och cytotoxiska aktivitet. Hos B-celler stimulerar SCFA aktivering och differentiering till groddcentrumb-celler och plasmaceller med ökad produktion av IgG och IgA, samtidigt som IgE-produktionen hämmas. De immunreglerande effekterna av SCFA sträcker sig därmed bortom tarmen. Medan Ffar2 är särskilt viktig för regleringen av ILC, spelar SCFA:s intracellulära effekter – bland annat via acetyl-CoA och hämning av histondeacetylaser (HDAC) – en dominerande roll för T- och B-cellsreglering.
Sammantaget stödjer SCFA lymfocyternas effektorfunktioner i försvaret mot mikrobiella patogener och cancer, men kan samtidigt försvaga immunitet mot helminter. SCFA har även antiinflammatoriska och antiallergiska effekter, delvis genom att stärka tarmens barriärimmunitet, stödja Treg-aktivitet och hämma IgE-produktion, mastceller och ILC2.
Hela artikeln här: Kim, C.H. Control of lymphocyte functions by gut microbiota-derived short-chain fatty acids. Cell Mol Immunol 18, 1161–1171 (2021). https://doi.org/10.1038/s41423-020-00625-0 , figur 2. Mycket intressant artikel för den som vill veta mer om av regleringen av immunförsvaret.
Kostfibrer är en central del av en hälsosam kost och spelar en avgörande roll för tarmens funktion, ämnesomsättning och långsiktig hälsa¹. Fibrer delas vanligtvis in i lösliga och olösliga, som verkar på olika sätt i mag–tarmkanalen men tillsammans bidrar till ett stabilt och motståndskraftig mikrobiom. Våra fiberprodukter Raw Fiber, Green Fiber och Yellow Fiber innehåller både lösliga och olösliga fibrer.
Lösliga fibrer löser sig i vatten och bildar en geléliknande struktur i tarmen. Denna egenskap gör att de kan bromsa upptaget av glukos och därmed bidra till stabilare blodsockernivåer och jämnare energitillgång². Lösliga fibrer kan även binda gallsyror, vilket är kopplat till sänkta LDL-kolesterolnivåer³. Dessutom fungerar många lösliga fibrer som prebiotika – de utgör näring för tarmens goda bakterier och bidrar till produktionen av kortkedjiga fettsyror, vilka är viktiga för tarmbarriärens funktion, låggradig inflammation och metabol balans¹,⁴. Dessa effekter är relevanta både för vardagshälsa och för personer som tränar regelbundet och vill stödja återhämtning och uthållighet.
Olösliga fibrer löser sig inte i vatten utan bidrar främst med volym och struktur i tarmen. De stimulerar tarmrörelser, ökar avföringens volym och bidrar till regelbunden tarmfunktion, vilket minskar risken för förstoppning och tarmrelaterade besvär⁴. Olösliga fibrer är också viktiga för mättnad och kan därigenom bidra till viktreglering⁵. Även om de inte fermenteras i samma utsträckning som lösliga fibrer, bidrar de till en robust tarmmiljö och kompletterar de lösliga fibrernas effekter.
För aktiva personer och idrottare är ett välfungerande mag–tarmssystem avgörande för att kroppen ska kunna tillgodogöra sig näring, upprätthålla stabil energi och återhämta sig effektivt mellan träningspass. Forskning visar att ett tillräckligt och varierat fiberintag är kopplat till bättre metabol kontroll, förbättrad lipidprofil och gynnsam påverkan på tarmmikrobiotan – faktorer som är centrala för både prestation och långsiktig hälsa³,⁵,⁶.
Sammanfattningsvis visar den samlade vetenskapliga litteraturen att en kombination av lösliga och olösliga fibrer, från både kosten och kompletterande fibertillskott, är en viktig grund för tarmhälsa, energibalans och motståndskraft – i vardagen såväl som vid fysisk belastning¹⁶.
Faktaruta:
Egenskaper: Löser sig i vatten och bildar en geléaktig substans i tarmen.
Hälsofördelar:
Hjälper till att sänka kolesterolnivåer genom att binda gallsyror.
Stabiliserar blodsockret genom att bromsa upptaget av glukos.
Ger en längre mättnadskänsla, vilket kan bidra till viktkontroll.
Gynnar tillväxten av goda tarmbakterier (prebiotisk effekt).
Minskar tarmläckage och därmed risken för diarre, magsjuka och tarmsjukdomar t ex Mb Crohn och IBD
Ökar motståndskraften mot infektioner av alla slag även från virus.
Livsmedelskällor:
Havregryn, korn, linfrön, psylliumfrön.
Frukt (t.ex. äpplen, päron, citrusfrukter).
Baljväxter (t.ex. linser, bönor, kikärtor).
Egenskaper: Löser sig inte i vatten och passerar i stort sett osmälta genom tarmen. Olösliga fibrer används av tarmens goda bakterier som näringskälla.
Hälsofördelar:
Minskar tarmläckage och därmed risken för diarre och magsjuka.
Minskar tarmsjukdomar som Mb Crohn, ulcerös colit
Ökar motståndskraften mot infektioner av alla slag även från virus.
Ökar volymen och mjukar upp avföringen, vilket förebygger förstoppning.
Stimulerar tarmrörelser och kan minska risken för tarmproblem som divertikulos.
Ger längre mättnad efter matintag och bidrar till viktkontroll.
Livsmedelskällor:
Fullkornsprodukter (t.ex. fullkornsbröd, råris, vetekli).
Nötter och frön.
Grönsaker (t.ex. morötter, kål, broccoli).
Fiberprodukter från H2health.se
Se artiklarna:
Genom att tillföra flera typer av kostfiber kan tarmfloran bli mer diversifierad och motståndskraftig. En sådan mikrobiell miljö ger bättre förutsättningar att hantera miljöbelastningar som mikroplaster och PFAS och minska deras påverkan på kroppen. Kostfiber spelar en avgörande roll i detta sammanhang, eftersom olika fibrer selektivt gynnar olika bakteriestammar och därmed ökar både mångfald och funktionell kapacitet i tarmfloran.
Ny forskning visar att vissa tarmbakterier kan binda, förändra eller delvis hantera mikro- och nanoplaster (MNP) samt PFAS, även om fullständig nedbrytning ännu inte är visad hos människa. Dessa bakterier – bland annat inom släktena Bacteroides, Blautia, Lactobacillus och Bifidobacterium – är samtidigt starkt beroende av ett regelbundet tillflöde av kostfiber för att kunna etableras och fungera optimalt.
Genom ett högt och varierat fiberintag:
Även om tarmfloran i dagsläget inte kan eliminera MNP eller PFAS fullt ut, tyder forskningen på att en välmående och diversifierad mikrobiota kan minska biologisk belastning, öka utsöndring och begränsa inflammatoriska effekter av dessa ämnen. I detta perspektiv blir kostfiber inte bara en fråga om matsmältning, utan en central komponent i kroppens långsiktiga motståndskraft.
Faktaruta
Kostfiber stärker tarmens skyddssystem
Ett varierat fiberintag gynnar en rik tarmflora som kan binda, hantera och begränsa effekterna av miljöexponeringar som mikroplaster och PFAS. Hög mikrobiell diversitet och stark tarmbarriär är avgörande för att minska låggradig inflammation och stödja kroppens långsiktiga hälsa.
Mikro- (<5 mm) och nanoplaster (<1 μm) är idag allestädes närvarande i miljön och har påvisats i mänskliga vävnader, inklusive blod, organ och hjärna. Ny forskning visar bioackumulering i hjärnvävnad, med ökande nivåer över tid och högre koncentrationer hos personer med neurodegenerativa tillstånd¹². Detta väcker oro för långsiktiga biologiska effekter.
Studier visar att mikro- och nanoplaster kan störa tarmmikrobiotan (dysbios) och skada tarmbarriären, vilket kan leda till ökad permeabilitet (“leaky gut”). Detta möjliggör passage av inflammationsdrivande molekyler till blodbanan och kan bidra till systemisk låggradig inflammation³⁴.
Nanoplaster har visats kunna passera blod–hjärnbarriären och inducera oxidativ stress och neuroinflammation i experimentella modeller⁵. Samtidigt kan tarmdysbios och inflammation påverka hjärnan via tarm–hjärn-axeln. Direkta kausala samband med autoimmuna eller neurologiska sjukdomar hos människa är ännu inte fastställda, men mekanismerna anses biologiskt plausibla³⁵⁶.
Ny forskning visar att vissa tarmbakterier kan binda, förändra eller delvis metabolisera mikroplaster och PFAS under experimentella förhållanden⁷⁸⁹. Om och i vilken utsträckning detta påverkar exponering och hälsa hos människor är ännu oklart och ett aktivt forskningsområde.
Dagens forskning pekar på mikro- och nanoplaster som en möjlig ny miljörelaterad riskfaktor för låggradig inflammation, med tarmen som central nod. Bevisläget hos människa är ännu under utveckling, men de biologiska mekanismerna motiverar fortsatt och fördjupad forskning.
Det finns i dag inga bevis för att människans tarmflora effektivt kan bryta ned mikro- och nanoplaster eller PFAS på ett sätt som eliminerar dem. Däremot finns växande evidens för att vissa tarmbakterier kan binda, förändra, transportera och delvis neutralisera exponeringen, vilket kan minska biologisk belastning.
Ny forskning visar att vissa tarmbakterier kan interagera med mikro- och nanoplaster samt PFAS genom bindning och partiell omvandling. Även om fullständig nedbrytning ännu inte är visad hos människa, tyder resultaten på att tarmmikrobiotan kan fungera som en biologisk buffert mot dessa miljöexponeringar.
Två artiklar med länkar
1) Bioackumulation av mikroplaster i människohjärnor
Nihart AJ et al. – Bioaccumulation of microplastics in decedent human brains (Nature Medicine, 2025)
https://pubmed.ncbi.nlm.nih.gov/40164728/
Denna studie rapporterar att mikro- och nanoplaster har detekterats i hjärnvävnad vid obduktion, med högre nivåer än i lever och njurar, och att de verkar öka över tid.
2) Översikt – 20 års mikroplastforskning
Thompson RC et al. – Twenty years of microplastic pollution research—what have we learned? (Science, 2024)
https://www.science.org/doi/10.1126/science.adl2746
En omfattande översikt som sammanfattar två decenniers forskning om mikroplastens spridning, källor, miljöpåverkan och potentiella risker.
Dagens evidens talar för att tarmflora och barriärfunktion är centrala regulatorer av immunbalans. Vid autoimmun sjukdom kan störningar i denna axel bidra till både sjukdomsinitiering och progression.
Forskning under det senaste decenniet visar att tarmfloran och tarmens barriärfunktion är aktiva regulatorer av immunbalans, snarare än passiva mottagare av immunologiska signaler. Vid dysbios kan balansen mellan regulatoriska T-celler (Treg) och proinflammatoriska Th17-celler rubbas, vilket är en väletablerad mekanism vid flera autoimmuna sjukdomar såsom multipel skleros, SLE, typ 1-diabetes och reumatoid artrit¹².
Tarmbakteriernas metaboliter, särskilt kortkedjiga fettsyror (SCFA) som butyrat (smörsyra), är centrala för att upprätthålla epitelcellernas energiförsörjning och integriteten i tarmens tight junctions. Minskad SCFA-produktion vid dysbios kan försämra barriärfunktionen och öka intestinal permeabilitet (“leaky gut”), vilket möjliggör passage av antigen och endotoxiner som kan trigga eller förstärka autoimmun inflammation³⁴.
Även om kausaliteten ännu inte är fullt klarlagd, antyder longitudinella och mekanistiska studier att dysbios och barriärstörning i vissa fall kan föregå klinisk autoimmun sjukdom, snarare än enbart vara en konsekvens². Detta har lett till ett växande intresse för mikrobiotaderiverade metaboliter som tidiga biomarkörer och potentiella terapeutiska mål.
Ett närliggande forskningsområde rör fytoöstrogener (t.ex. isoflavoner och lignaner), vars immunmodulerande effekter är starkt beroende av tarmflorans förmåga att metabolisera dem till bioaktiva former såsom equol. Experimentella modeller av autoimmun neuroinflammation visar att en fytoöstrogenrik kost kan minska sjukdomsaktivitet – men endast i närvaro av en kompatibel mikrobiota⁵. Detta illustrerar hur kost, mikrobiota och immunrespons samverkar, och varför framtida kostråd vid autoimmunitet sannolikt behöver individualiseras.
Sammantaget pekar forskningen på att tarmflora, barriärfunktion och mikrobiella metaboliter utgör en central nod i autoimmun patofysiologi, med potentiella implikationer för diagnostik, prevention och behandling – även om human evidens ännu är under utveckling.
Utvalda nyckelreferenser (med länkar)
Sadeghpour Heravi F et al. (2024)
Gut microbiota and autoimmune diseases: mechanisms and challenges.
Current Rheumatology Reports
https://pubmed.ncbi.nlm.nih.gov/38241771/
Li G et al. (2025)
Gut microbiota–derived metabolites modulate Treg/Th17 balance in autoimmunity.
Frontiers in Immunology
https://www.frontiersin.org/articles/10.3389/fimmu.2025.XXXXX
Martinelli S et al. (2024)
Microbiota–immunity–hormone interactions in autoimmune diseases.
Biomedicines
https://www.mdpi.com/2227-9059/12/1/XXX
English J (2024)
Increased intestinal permeability and autoimmunity.
Current Treatment Options in Allergy
https://pubmed.ncbi.nlm.nih.gov/38109214/
Jensen SN et al. (2021)
Isoflavone diet ameliorates experimental autoimmune encephalomyelitis via gut microbiota.
Science Advances
https://www.science.org/doi/10.1126/sciadv.abc1234
Chander AM et al. (2018)
Cross-talk between gluten, intestinal microbiota and celiac disease.
Frontiers in Microbiology
https://www.frontiersin.org/articles/10.3389/fmicb.2018.XXXX
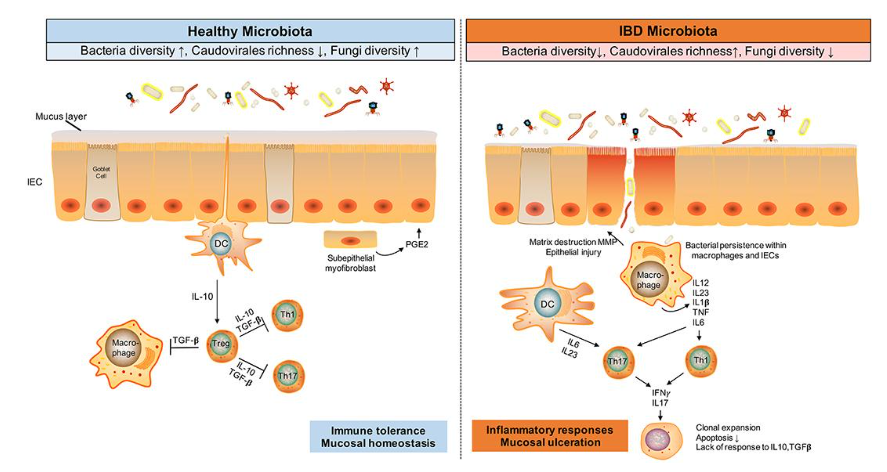
Figur 1. Förändringar i tarmmikrobiotan och immunrespons vid IBD.
Tarmens mikrobiota – inklusive bakterier, virus och svampar – samverkar med immunförsvaret och spelar en central roll i patogenesen vid inflammatorisk tarmsjukdom (IBD). Under homeostas bidrar mikrobiotan till immunologisk tolerans. Vid IBD leder dysbios till aktivering av Th1- och Th17-celler samt bristande regulatorisk T-cellsfunktion, vilket orsakar vävnadsskada, förtunnat slemhinnebarriär och ökad mikrobiell penetration. Denna mukosala skada förstärker upptaget av mikrobiella antigen och driver en självförstärkande inflammatorisk respons.
Förkortningar: TGF, transformerande tillväxtfaktor; MMP, matrixmetalloproteinas; DC, dendritisk cell (Ur Zuo et al: The Gut Microbiota in the Pathogenesis and Therapeutics of Inflammatory Bowel Disease, Front. Microbiol., 25 September 2018)
Inflammatorisk tarmsjukdom (IBD), inklusive Crohns sjukdom och ulcerös kolit, utgör ett tydligt exempel på hur samspelet mellan tarmflora, barriärfunktion och immunreglering kan driva kronisk autoimmun/inflammatorisk sjukdom. Till skillnad från systemiska autoimmuna sjukdomar är inflammationen vid IBD lokaliserad till tarmslemhinnan, men de underliggande mekanismerna överlappar i hög grad med andra autoimmuna tillstånd.
Vid IBD ses en karakteristisk dysbios med minskad mikrobiell diversitet, reducerad förekomst av butyratproducerande bakterier (t.ex. Faecalibacterium prausnitzii) och ökad andel proinflammatoriska taxa. Denna förändrade mikrobiota är associerad med nedsatt produktion av kortkedjiga fettsyror (SCFA), särskilt butyrat, vilket försämrar epitelcellernas energimetabolism och försvagar tight junctions i tarmslemhinnan¹⁶.
Barriärdysfunktion är ett centralt patofysiologiskt inslag vid IBD. Ökad intestinal permeabilitet kan ofta påvisas tidigt i sjukdomsförloppet och även hos friska förstagradssläktingar till IBD-patienter, vilket talar för att barriärsvikt inte enbart är en konsekvens av inflammation utan kan bidra till sjukdomsinitiering⁷. Passage av mikrobiella antigen och endotoxiner över epitelet aktiverar det mukosala immunsystemet och driver en ihållande Th17- och Th1-dominerad inflammatorisk respons.
Immunologiskt kännetecknas IBD av en rubbning i balansen mellan regulatoriska T-celler (Treg) och proinflammatoriska T-celler, där nedsatt Treg-funktion och överproduktion av cytokiner som IL-17, TNF-α och IL-23 spelar en central roll. Flera av dessa signalvägar är direkt eller indirekt mikrobiotaberoende, vilket ytterligare stärker kopplingen mellan dysbios och kronisk tarminflammation²⁸.
IBD har därför blivit ett viktigt modellsystem för att studera mikrobiotabaserade interventioner. Fekal mikrobiotatransplantation (FMT), kostinterventioner och riktade pre- och probiotiska strategier har visat lovande men varierande resultat, vilket understryker att mikrobiotans funktionella egenskaper – snarare än enskilda bakterier – sannolikt är avgörande för terapeutisk effekt⁹. Dessa erfarenheter är direkt relevanta även för systemiska autoimmuna sjukdomar, där liknande principer för individualiserad behandling kan komma att tillämpas.
Sammantaget illustrerar IBD hur störningar i tarmflora–barriär–immun-axeln kan leda till kronisk autoimmun inflammation, och hur denna axel kan fungera både som sjukdomsdrivare, biomarkör och potentiellt terapeutiskt mål.
Raw Fiber – potentiell nytta för tarmflora och barriärfunktion
Tillskott av fermenterbara fibrer bidrar till att stödja tarmflorans diversitet och den mikrobiella produktionen av kortkedjiga fettsyror (SCFA), särskilt butyrat. Raw Fiber innehåller en bred sammansättning av växtbaserade fibrer som kan fungera som substrat för kommensala bakterier och därigenom indirekt stärka både barriärfunktion och immunreglering.
Vid autoimmuna tillstånd och inflammatorisk tarmsjukdom är dock mikrobiotan ofta instabil, och epitelet kan vara extra känsligt. En snabb ökning av fermenterbara fibrer kan då leda till gasbildning, buksmärta, diarré eller försämrade inflammatoriska symtom. Av denna anledning är försiktig och gradvis upptrappning avgörande för att ge de nyttiga bakterierna tid att växa till i antal.
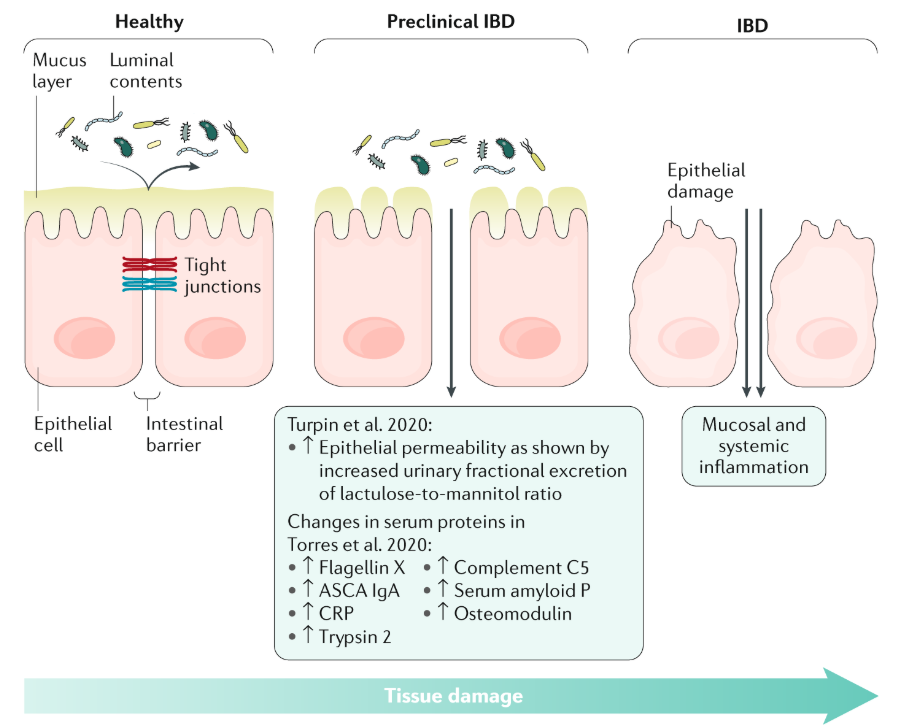
(Ur Mehandru, S., Colombel, JF. The intestinal barrier, an arbitrator turned provocateur in IBD. Nat Rev Gastroenterol Hepatol 18, 83–84 (2021). https://doi.org/10.1038/s41575-020-00399-w)
Rekommenderad uppstart:
Börja med 1 tesked Raw Fiber per dag.
Öka långsamt dosen över tid, med målet upp till 2 matskedar per dag eller mer, beroende på individuell tolerans. Blötlägg gärna innan, särskilt vid högre doser.
Varje dosökning bör ske först efter att föregående nivå tolererats väl under flera dagar.
Om en negativ reaktion uppstår (t.ex. ökade mag-tarmsymtom eller allmän inflammatorisk försämring) rekommenderas att:
Avbryta intaget och avvakta cirka en vecka innan nytt försök görs.
Därefter återstarta enligt samma försiktiga schema, från låg dos.
Om en negativ reaktion uppstår även vid andra försöket, föreslås istället att man prövar Green Fiber eller Yellow Fiber, enligt motsvarande princip:
Start med 1 tesked per dag,
långsam upptrappning,
samt paus och omvärdering vid symtom.
Denna stegvisa strategi syftar till att ge mikrobiotan tid att adaptera till ökad fiberfermentation och minska risken för överdriven gasproduktion eller immunaktivering. Erfarenheter från både IBD-forskning och klinisk nutrition visar att individuell tolerans är avgörande, och att långsam upptrappning ofta är en förutsättning för långsiktig nytta.
Referenser
Ni J et al. (2017)
Gut microbiota and IBD: causation or correlation?
Nature Reviews Gastroenterology & Hepatology
https://pubmed.ncbi.nlm.nih.gov/28224954/
Zhang YZ & Li YY (2014)
Inflammatory bowel disease: pathogenesis.
World Journal of Gastroenterology
https://pubmed.ncbi.nlm.nih.gov/25232224/
Bischoff SC et al. (2014)
Intestinal permeability – a new target for disease prevention and therapy.
BMC Gastroenterology
https://pubmed.ncbi.nlm.nih.gov/24410975/
Lavelle A & Sokol H (2020)
Gut microbiota-derived metabolites as key actors in inflammatory bowel disease.
Nature Reviews Gastroenterology & Hepatology
https://pubmed.ncbi.nlm.nih.gov/31959958/
Paramsothy S et al. (2017)
Multidonor intensive faecal microbiota transplantation for active ulcerative colitis.
The Lancet
En antiinflammatorisk kost, ofta illustrerad genom medelhavskost eller klassisk nordisk kost, bygger huvudsakligen på ett högt intag av fullkornsprodukter, rotfrukter och säsongsanpassade grönsaker, baljväxter, nötter, frön och frukt. Dessa livsmedel tillför stora mängder kostfiber, vitaminer, mineraler och bioaktiva ämnen som sammantaget stödjer en gynnsam tarmmikrobiota och bidrar till minskad låggradig inflammation i kroppen [1–4].
Som fettkällor rekommenderas måttliga mängder olivolja eller oraffinerad rapsolja, vilka bidrar med enkelomättade fettsyror och antiinflammatoriska komponenter. För många människor är det dock svårt att nå ett optimalt fiberintag enbart via kosten. Här kan Raw Fiber fungera som ett praktiskt tillskott för att komplettera den dagliga kosten och bidra till ett totalt fiberintag i storleksordningen 50–100 gram per dag, nivåer som i forskningen kopplats till förbättrad metabol hälsa och stärkt tarmbarriärfunktion [1–4].
Dysbios, inflammation och metabol obalans
Om de normala (kommensala) bakterierna i tarmen inte tillförs tillräckliga mängder kostfiber gynnas i stället bakterier med potentiellt sjukdomsframkallande egenskaper. Detta leder till ett tillstånd som benämns dysbios [1,2]. Vid dysbios minskar produktionen av kortkedjiga fettsyror (SCFA), samtidigt som slemlagret närmast tarmepitelet tunnas ut och tarmbarriärens täta fogar (så kallade tight junctions försvagas [1–4]. Detta ökar tarmens genomsläpplighet och möjliggör passage av bakterier och bakteriella komponenter till blodbanan, vilket driver systemisk inflammation.
Den ökade inflammationen påverkar immunsystemets reglering. Regulatoriska T-celler, som normalt dämpar inflammatoriska processer, fungerar sämre vid dysbios, vilket bidrar till kroniskt förhöjd inflammation [2,4]. Samtidigt minskar frisättningen av mättnadshormoner, insulinkänsligheten försämras och risken för övervikt, fettlever och andra metabola sjukdomar ökar [2,3].
Kostfiber, mitokondrier och energi
Mitokondrierna fungerar som kroppens energikraftverk och ansvarar för produktionen av ATP, den energi som cellerna använder för sina funktioner. Vid fiberrik kost fermenteras kostfibrer av tarmbakterier till kortkedjiga fettsyror, särskilt smörsyra (butyrat), som både fungerar som energikälla för tarmcellerna och som signalmolekyl som förbättrar mitokondriernas funktion [1–4].
När produktionen av SCFA är god förbättras mitokondriernas effektivitet, energiproduktionen blir stabilare och den oxidativa stressen minskar. Vid låg fiberkonsumtion minskar däremot SCFA-produktionen, vilket bidrar till sämre mitokondriell funktion, lägre energitillgänglighet och ökad inflammation i kroppen [3,4].
Genom att tillföra ett brett spektrum av kostfibrer, exempelvis via Raw Fiber, ges de goda tarmbakterierna förutsättningar att producera tillräckliga mängder SCFA. Detta stödjer mitokondriernas energiproduktion, bidrar till bättre blodsockerreglering och hjälper kroppen att bryta den onda cirkeln av inflammation och metabol obalans [1–4].
Fördelar för idrottsutövare och fysiskt aktiva
För idrottsutövare ställs särskilt höga krav på effektiv energiproduktion, återhämtning och kontroll av inflammation. Studier visar att tarmmikrobiotans sammansättning och produktionen av kortkedjiga fettsyror är kopplade till uthållighet, träningsprestation och återhämtning [5–7].
En fiberrik kost, eller komplettering med Raw Fiber, kan bidra till förbättrad mitokondriell energiproduktion i muskelcellerna, minskad träningsrelaterad inflammation och stabilare energinivåer under träning. Detta kan i praktiken innebära bättre uthållighet, snabbare återhämtning mellan träningspass och minskad risk för mag-tarmbesvär vid fysisk belastning [5–7].
Sammanfattning
Kostfiber spelar en central roll i samspelet mellan tarmmikrobiota, immunförsvar och mitokondriell energiproduktion. Vid brist på fiber uppstår dysbios, inflammation och försämrad energiomsättning. Genom en antiinflammatorisk kost, kompletterad med Raw Fiber, kan dessa processer påverkas i gynnsam riktning, vilket skapar bättre förutsättningar för god hälsa, metabol balans och fysisk prestation.
Referenser
7. Zhang X, et al. Exercise and diet reshape athletes’ gut microbiota. Life. 2025;15(12):1812. https://www.mdpi.com/2075-1729/15/12/1812
Se bilden till vänster
Rikligt med fibrer i kosten gynnar goda bakterier och medför att tarmslemhinnan inte släpper in skadliga bakterier i blodet. De goda bakterierna stimulerar tarmväggen att bilda rikligt med skyddande slem. Vi mår bättre ju fler olika kommensala bakterier vi har i tarmens normalflora. Tarmfloran blir då stabilare och kan stå emot infektioner bättre, exemplet nedan visar Covid19, men det visar sig att man har en störd bakterieflora i tarmen vid de flesta sjukdomar.
Ett tillskott av två rågade matskedar Raw Fiber per dag tillsammans med en antiinflammatorisk kost kan räcka för att stoppa läckande tarm.
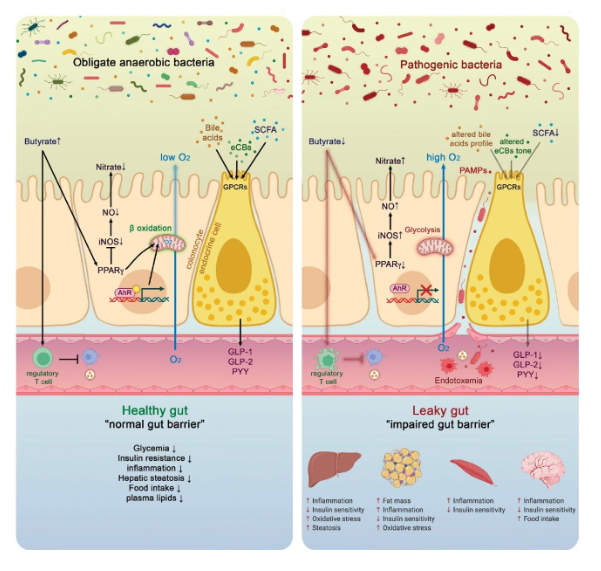
Viktminskning
Antiinflammatorisk kost med extra kostfiber spelar en viktig roll vid viktminskning genom att öka mättnadskänslan och minska det totala energiintaget. Fibrer fördröjer magsäckstömningen och bidrar till stabilare blodsockernivåer, vilket kan minska småätande. I tjocktarmen fermenteras vissa fibrer av tarmbakterier till kortkedjiga fettsyror, som påverkar aptitreglerande hormoner och energimetabolism. Ett fiberrikt kostmönster är därför kopplat till bättre viktkontroll och minskad risk för viktuppgång över tid.
Kostfiber påverkar aptit och energibalans via tarmhormoner och metaboliter. Fermentering av fiber i tjocktarmen ökar frisättningen av hormoner som GLP-1 och PYY (bilden ovan till vänster), vilka förstärker mättnad och minskar aptiten. Samtidigt dämpas nivåerna av hungerhormonet ghrelin. De kortkedjiga fettsyror som bildas påverkar även insulinfrisättning och fettinlagring, vilket sammantaget kan underlätta viktminskning och viktkontroll.
Blodsocker, blodfetter, insulinresistens
Ett fiberrikt kostmönster förbättrar glukos- och lipidmetabolismen. Lösliga kostfibrer bromsar upptaget av kolhydrater i tunntarmen, vilket leder till lägre och jämnare blodsockersvar samt minskat insulinpåslag efter måltid (bilden ovan). På längre sikt kan detta förbättra insulinkänsligheten och minska insulinresistens. Samtidigt bidrar fiber till sänkta blodfetter, särskilt LDL-kolesterol, genom ökad gallsyreutsöndring och förändrad lipidomsättning i levern. Dessa effekter är centrala för att minska risken för metabol sjukdom.
Kronisk inflammation
Kostfiber bidrar till att dämpa kronisk låggradig inflammation. När fibrer fermenteras av tarmmikrobiotan bildas kortkedjiga fettsyror, särskilt butyrat (smörsyra), som stärker tarmbarriären och minskar passage av inflammationsdrivande ämnen till blodbanan. Detta leder till lägre systemisk immunaktivering och minskade nivåer av inflammatoriska markörer. Genom förbättrad tarmbarriär, lägre endotoxinbelastning och bättre metabol reglering kan ett fiberrikt kostmönster motverka kronisk inflammation som är kopplad till metabola och kardiovaskulära sjukdomar som diabetes och hjärtkärlsjukdom (bilden ovan).
Bilden ovan till höger
Om de normala (kommensala) bakterierna i tarmen inte tillförs tillräckliga mängder kostfiber via kosten gynnas i stället bakterier med potentiellt sjukdomsframkallande egenskaper, vilket leder till ett tillstånd som benämns dysbios [1,2]. Vid dysbios minskar produktionen av kortkedjiga fettsyror (SCFA), samtidigt som slemlagret närmast tarmepitelet tunnas ut och tarmbarriärens täta fogar (så kallade tight junctions) försvagas [1,2]. Detta ökar genomsläppligheten i tarmen och möjliggör passage av bakterier och bakteriella komponenter till blodbanan, vilket driver systemisk inflammation [6,7].
SCFA, särskilt butyrat, spelar en central roll för både tarmcellernas energiförsörjning och kroppens övergripande energimetabolism. Dessa ämnen fungerar som signalmolekyler som förbättrar mitokondriernas funktion och effektiviteten i cellernas energiproduktion [1,3]. När produktionen av SCFA minskar försämras mitokondriernas funktion, vilket leder till lägre ATP-produktion och ökad oxidativ stress i vävnader som muskler och lever [3,6].
Den ökade inflammationen påverkar även immunsystemets reglering. Regulatoriska T-celler, som normalt dämpar inflammatoriska processer, fungerar sämre vid dysbios, vilket bidrar till en kroniskt förhöjd inflammationsnivå [2]. Samtidigt minskar frisättningen av mättnadshormoner och insulinkänsligheten försämras, vilket ytterligare driver metabol obalans [2,6].
För idrottsutövare är dessa mekanismer särskilt relevanta. Studier visar att tarmmikrobiotans sammansättning och SCFA-produktion är kopplade till uthållighet, återhämtning och träningsprestation [3–5]. En fiberrik kost, eller komplettering med fibertillskott såsom Raw Fiber, kan därför bidra till förbättrad mitokondriell energiproduktion, minskad träningsrelaterad inflammation och snabbare återhämtning mellan träningspass [3,4].
Genom att tillföra ett brett spektrum av kostfibrer stödjer Raw Fiber de goda tarmbakterierna och deras produktion av SCFA. Detta skapar gynnsamma förutsättningar för effektiv energiproduktion i mitokondrierna, stabilare blodsocker, förbättrad fettförbränning och en lägre inflammationsnivå i hela kroppen – faktorer som är avgörande både för allmän hälsa och fysisk prestation [1–6]
Referenser
Mitokondrier – kroppens små kraftverk
I varje cell finns mitokondrier, som kan liknas vid små kraftverk. Deras uppgift är att omvandla maten vi äter till energi (ATP) som kroppen använder för allt från rörelse och koncentration till immunförsvar och läkning. När mitokondrierna fungerar bra känner man sig pigg, mätt och stabil i energi. När de fungerar sämre uppstår trötthet, inflammation och lättare viktuppgång.
Vad händer när vi äter tillräckligt med fibrer?
Kostfiber kan inte brytas ner av kroppen själv, men de är livsviktiga för de goda bakterierna i tarmen. När dessa bakterier får fibrer börjar de producera små energirika ämnen som kallas kortkedjiga fettsyror.
En av dessa, butyrat (smörsyra) har en nyckelroll:
Resultatet blir att cellerna kan skapa mer energi med mindre inflammation. Samtidigt förbättras mättnadskänslan, blodsockret blir stabilare och kroppen blir bättre på att använda fett som bränsle.
Vad händer när vi får i oss för lite fibrer?
Vid låg fiberkonsumtion ”svälter” de goda tarmbakterierna. Då minskar produktionen av de kortkedjiga fettsyrorna, och mitokondrierna får sämre stöd.
Konsekvenserna blir att:
Många upplever detta som trötthet, sötsug, viktuppgång, värk och minskad ork.
Raw Fiber – ett direkt stöd för energiproduktionen
Här fungerar Raw Fiber som en praktisk och effektiv intervention. Genom att tillföra ett brett spektrum av naturliga fibrer ger Raw Fiber näring till de goda tarmbakterierna, även när kosten i övrigt inte räcker till.
När Raw Fiber används regelbundet:
Detta skapar bättre förutsättningar för att:
Sammanfattning
Fibrer matar tarmbakterierna
Tarmbakterierna hjälper mitokondrierna
Mitokondrierna ger kroppen energi
Raw Fiber fungerar som en genväg till denna kedja när det är svårt att få i sig tillräckligt med fibrer via maten.
Fördelar för idrottsutövare och fysiskt aktiva
För idrottsutövare ställs höga krav på kroppens förmåga att producera energi, återhämta sig och hantera inflammation. Mitokondrierna i muskelcellerna spelar här en avgörande roll, eftersom de står för huvuddelen av den energi som krävs vid både uthållighets- och styrketräning.
Mer effektiv energiproduktion
När kosten är rik på kostfiber, eller kompletteras med Raw Fiber, gynnas tarmbakteriernas produktion av kortkedjiga fettsyror. Dessa ämnen förbättrar mitokondriernas funktion och gör att musklerna kan producera mer energi per syreenhet. För idrottsutövare innebär detta:
bättre uthållighet
jämnare energinivåer under träning
mindre tidig trötthet
Snabbare återhämtning
Träning orsakar naturligt mikroskador och inflammation i musklerna. En välfungerande tarm och låggradig systemisk inflammation gör att återhämtningen går snabbare. Genom att stödja tarmfloran med Raw Fiber minskar den onödiga inflammationen, vilket kan bidra till:
kortare återhämtningstid mellan pass
mindre träningsvärk
bättre kontinuitet i träningen
Stabil mage och bättre näringsupptag
Många idrottsutövare upplever magproblem vid hård träning eller tävling. En stark tarmbarriär, som gynnas av tillräckligt fiberintag, minskar risken för mag-tarmbesvär och förbättrar upptaget av viktiga näringsämnen. Raw Fiber kan därmed bidra till:
bättre tolerans för kolhydrater och protein
minskad risk för magproblem vid belastning
stabilare blodsocker under långa träningspass
Praktiskt stöd i en aktiv vardag
För idrottsutövare med högt energibehov kan det vara svårt att samtidigt få i sig tillräckligt med fibrer. Raw Fiber fungerar då som ett enkelt komplement som inte konkurrerar med energiintaget men ändå ger ett starkt stöd till tarm, mitokondrier och immunförsvar.
Sammanfattning för idrottare
Stödjer mitokondriernas energiproduktion
Förbättrar uthållighet och ork
Påskyndar återhämtning
Minskar träningsrelaterad inflammation
Bidrar till stabil mage och jämn prestation
Primär referens (översiktsartikel)
Referenser:
den Besten G, van Eunen K, Groen AK, Venema K, Reijngoud D-J, Bakker BM. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism. Journal of Lipid Research. 2013;54(9):2325-2340.
Denna översiktsartikel sammanfattar hur kortkedjiga fettsyror (SCFAs) – de huvudsakliga metaboliterna av kostfiber i tarmen – bildas och hur de påverkar värdens energiomsättning och metabolism, inklusive molekylära mekanismer och samband till värdens energibalans.
Länk till PubMed-sammanfattning: https://pubmed.ncbi.nlm.nih.gov/23821742/
Nogal A, Valdes AM, Men C. The role of short-chain fatty acids in the interplay between gut microbiota and diet in cardio-metabolic health. Gut Microbes. 2021.
En uppdaterad översikt som sammanfattar SCFA-produktion från kostfiber och dess effekter på värdens glukos- och lipidmetabolism och systemisk energibalans.
PubMed-länk: https://pubmed.ncbi.nlm.nih.gov/33764858/
Vätgas-/syrgasinhalering är en framväxande behandlingsmetod som under senare år fått ökande kliniskt och vetenskapligt intresse, främst i Asien, Australien och USA, men som nu även uppmärksammas i Europa. Forskning inom området har bedrivits i Östeuropa under lång tid, och i Storbritannien har Grace Russell nyligen disputerat inom området molekylärt väte som medicinsk gas.
Intresset bygger på att molekylärt väte (H₂) uppvisar antioxidativa, antiinflammatoriska och cellskyddande effekter, bland annat genom selektiv neutralisering av skadliga reaktiva syreföreningar (ROS) och modulering av cellens redoxbalans¹²³. Kombinationen gör tekniken särskilt relevant vid tillstånd präglade av kronisk inflammation, oxidativ stress och mitokondriell dysfunktion, såsom långvarig trötthet, post-covid-tillstånd och fibromyalgi. Vätgas har även uppmärksammats för potentiella effekter på cellöverlevnad och minskad apoptos, vilket i experimentella modeller kopplats till långsammare åldrandeprocesser på cellnivå.
I experimentella modeller har inhalerat H₂ visats minska oxidativ stress och systemisk inflammation, bland annat genom sänkta nivåer av fria syreradikaler och påverkan på genuttryck kopplat till antioxidativ respons⁴⁵. Djurstudier visar dessutom att vätgasinhalering kan dämpa lunginflammation och förbättra histologiska markörer vid både akuta och kroniska lungskador⁶. Kliniska observationer hos människa pekar på minskad oxidativ stress i blodet och förbättrade inflammatoriska biomarkörer efter inhalation⁷.
Modern forskning visar att H₂ fungerar som en selektiv antioxidant, främst riktad mot hydroxylradikalen (·OH) och peroxynitrit (ONOO⁻), utan att störa fysiologiskt viktiga signalmolekyler såsom kväveoxid (NO·) eller väteperoxid (H₂O₂)¹. Detta skiljer vätgas från bredverkande antioxidanter som kan påverka normal cellsignalering.
Även om H₂ länge betraktades som biologiskt inert har dess terapeutiska potential uppmärksammats sedan det visats att gasen snabbt kan diffundera in i vävnader, organ och celler och där neutralisera särskilt skadliga ROS³.
Utöver direkt radikalfångning påverkar H₂ även cellens redoxstatus indirekt. Russell beskriver hur vätgas kan modulera redoxkänsliga signalvägar och aktivera transkriptionsfaktorer såsom Nrf2, som reglerar uttrycket av över 200 cytoprotektiva gener, inklusive SOD, katalas, glutathionperoxidas och tioredoxin⁸. Detta innebär att H₂ inte bara neutraliserar ROS utan även förstärker cellens egna antioxidant- och reparationssystem.
Nrf2 fungerar som en central regulator av cellens antioxidativa och antiinflammatoriska försvar. När Nrf2 aktiveras ökar uttrycket av gener som skyddar mitokondrier, minskar inflammation och förbättrar avgiftningsprocesser.
Ett av de viktigaste Nrf2-beroende enzymerna är heme oxygenase-1 (HO-1), som ger antiinflammatoriska, antioxidativa och cellskyddande effekter och betraktas som en central skyddsmekanism vid stress och vävnadsskada⁸.
H₂ har i experimentella och kliniska studier visats stabilisera mitokondriell membranpotential, minska överproduktion av ROS i elektrontransportkedjan och förbättra cellens energimetabolism⁵. Genom förbättrad redoxbalans kan H₂ indirekt stödja flera redoxberoende enzymsystem, vilket bidrar till ett förstärkt endogent skydd mot oxidativ belastning.
Antiinflammatoriska effekter av H₂ rapporterades redan i tidiga studier⁹. Senare forskning visar att vätgas kan minska nivåerna av proinflammatoriska cytokiner såsom TNF-α, IL-1β och IL-6, samtidigt som antiinflammatoriska mediatorer som IL-10 ökar⁶.
H₂ påverkar även immuncellernas rekrytering genom att nedreglera adhesionsmolekyler såsom ICAM-1 och minska kemokinfrisättning. Detta leder till minskad infiltration av neutrofiler och M1-makrofager samt förbättrad fagocytos vid vävnadsskada⁶.
Syrgasinhalering förbättrar vävnadernas syremättnad och kan därigenom stödja metabolism och cellfunktion. När syrgas kombineras med vätgas kan effekterna förstärkas genom att både optimera syresättning och samtidigt dämpa oxidativ stress. Av säkerhetsskäl används vanligtvis inte mer än 4 % ren vätgas, men i kombination med syrgas kan högre effektiva doser uppnås utan risk för hypoxi.
En vanlig behandlingsgas består av cirka 66 % vätgas och 33 % syrgas, producerad genom elektrolys av avjoniserat vatten. Inhalation sker via näsgrimma eller mask under 30–180 minuter beroende på protokoll. Metoden används i ökande omfattning globalt, särskilt vid återhämtning, kronisk inflammation och respiratoriska tillstånd.
Det växande intresset för vätgas (H₂) som medicinsk behandling har på senare år även omfattat dess potentiella påverkan på tarmmikrobiomet. Studier visar att H₂:s roll i tarmens fermentering kan påverka produktionen av metaboliter som är viktiga för tarmens funktion och immunmodulation.
I en experimentell studie visades att vätgas fungerar som en regulator i fermenteringsprocesser i tarmen, där högre koncentrationer av H₂ främjar produktion av kortkedjiga fettsyror såsom butyrat, en metabolit associerad med antiinflammatorisk effekt och epitelcellernas energimetabolism¹. Detta tyder på att H₂ inte bara är en inert gas, utan kan interagera med mikrobiell metabolism och därmed indirekt med värdens immunologiska miljö¹.
Forskning i djurmodeller har också indikerat att vätgasinhalation kan påverka tarmens barriärfunktion och mikrobiotans sammansättning i samband med metabol stress. Exempelvis har inhalation av H₂ visat positiva effekter på tarm–lever-axeln och minskad inflammation i levern i modeller för fettlever, vilket antyder modulering av mikrobiomet och barriärfunktion². Detta ligger i linje med andra fynd som visar kopplingar mellan H₂-behandling och tarmbarriärens integritet i experimentella sammanhang⁴.
Även vätgas via vatten (”hydrogen-rich water”) har studerats för mikrobiomeffekter. Översikter och interventionsstudier tyder på att intag av hydrogenerat vatten kan vara associerat med ökad förekomst av butyratproducerande bakterier och förbättrade markörer för tarmhälsa, både i djurmodeller och i kliniska studier³⁵. I en av de tidigaste längre studierna på människor observerades ökningar i mikrobiell diversitet och minskade inflammationsmarkörer efter två månaders intag av H₂-berikat vatten hos fysiskt aktiva ungdomar⁵.
I klinisk kontext finns även studier där vätgasinhalation förbättrade tarmmikrobiotans diversitet hos patienter med ulcerös kolit, även om detta inte översattes till entydigt klinisk förbättring av sjukdomsaktiviteten⁶. Detta illustrerar att förändringar i mikrobiomet inte nödvändigtvis innebär direkt terapeutisk effekt men kan indikera modulering av tarmens ekologi.
Sammanfattningsvis visar dagens forskning att vätgas – särskilt i sammanhang med inflammation, dysbios eller metabol belastning – kan påverka mikrobiomet, stödja barriärfunktion och reducera inflammatoriska processer¹³. Evidensläget är emellertid fortfarande tidigt och begränsat, med få större kliniska prövningar. Effekter hos friska individer och långtidssäkerhet är ännu otillräckligt utforskade. Vätgas framstår därför som en lovande men experimentell möjlighet för mikrobiomodulering, inte som etablerad behandling.
Maruyama T et al. Hydrogen gas inhalation improved intestinal microbiota in patients with ulcerative colitis. Principles and Practice of Microbiome Research (2025).
https://www.mdpi.com/2227-9059/13/8/1799
Ett växande forskningsunderlag visar att tidiga demenssjukdomar och perifera neuropatier i hög grad är kopplade till låggradig, kronisk inflammation snarare än enbart till klassisk neurodegeneration. Neuroinflammation, mikrogliaaktivering, oxidativ stress och nedsatt funktion i blod–hjärnbarriären betraktas idag som centrala mekanismer i sjukdomsinitiering och progression, ofta flera år innan kliniska symtom blir tydliga¹².
Systemisk inflammation och barriärstörningar – inklusive dysfunktion i tarmbarriären – kan förstärka neuroinflammatoriska processer via tarm–hjärna-axeln. Detta har lett till ökat fokus på interventioner som indirekt kan modulera hjärnans inflammatoriska miljö genom påverkan på tarmflora, immunrespons och oxidativ stress.
Fibrer och tarm–hjärna-axeln
Fermenterbara kostfibrer metaboliseras av tarmens mikrobiota till kortkedjiga fettsyror (SCFA), framför allt butyrat (smörsyra), vilka har dokumenterade antiinflammatoriska effekter och stärker integriteten i både tarmbarriären och blod–hjärnbarriären³⁴. SCFA kan även påverka mikrogliaaktivitet och minska systemisk inflammationssignalering, vilket är relevant vid tidig kognitiv svikt och neuropatier.
Vid dessa tillstånd ses ofta samtidig dysbios och ökad intestinal permeabilitet, vilket kan bidra till ett kroniskt inflammatoriskt tillstånd som sekundärt påverkar nervsystemet. En individualiserad och försiktigt upptrappad fiberstrategi kan därför betraktas som ett sätt att minska inflammatorisk belastning snarare än som en direkt behandling av neurodegeneration.
Vätgasinhalering (H₂) och oxidativ stress
Molekylärt väte (H₂) har i prekliniska och tidiga kliniska studier visat antioxidativa och antiinflammatoriska egenskaper. H₂ kan selektivt neutralisera särskilt reaktiva syreradikaler och därigenom minska oxidativ stress – en central drivkraft bakom neuroinflammation, mitokondriell dysfunktion och nervskada⁵⁶.
Eftersom H₂ är en liten och neutral molekyl kan den passera biologiska barriärer, inklusive blod–hjärnbarriären. Detta har lett till hypotesen att vätgasinhalering kan fungera som ett stödjande verktyg för att dämpa inflammatoriska och oxidativa processer i nervsystemet, särskilt i tidiga sjukdomsstadier. Det är dock viktigt att betona att den kliniska evidensen fortfarande är begränsad och att behandlingen bör betraktas som experimentell⁶⁷. Inga biverkningar har noterats med denna behandling.
Sammanfattande perspektiv
Ur ett inflammatoriskt systemsynsätt kan både tidiga demenssjukdomar och neuropatier förstås som tillstånd där tarm, immunförsvar och nervsystem är funktionellt sammanlänkade. Strategier som syftar till att:
kan därför vara relevanta som komplement i ett bredare, individualiserat angreppssätt. Fibrer och vätgasinhalering representerar två olika men potentiellt samverkande interventioner inom detta ramverk, även om ytterligare humanstudier krävs innan kliniska rekommendationer kan fastställas.
Referenser
Neuroinflammation in Alzheimer’s disease.
The Lancet Neurology
https://pubmed.ncbi.nlm.nih.gov/25987256/
Neuroinflammation and microglial activation in Alzheimer disease.
Nature Reviews Neurology
https://pubmed.ncbi.nlm.nih.gov/33686263/
The microbiota–gut–brain axis.
Physiological Reviews
https://pubmed.ncbi.nlm.nih.gov/30768296/
Role of dietary fiber and short-chain fatty acids in gut and brain health.
Journal of Clinical Medicine
https://www.sciencedirect.com/science/article/pii/S1756464625002129
Molecular hydrogen as a preventive and therapeutic medical gas.
Pharmacology & Therapeutics
https://pubmed.ncbi.nlm.nih.gov/24681775/
Beneficial biological effects and the underlying mechanisms of molecular hydrogen.
Journal of Clinical Biochemistry and Nutrition
https://pubmed.ncbi.nlm.nih.gov/26247973/
Molecular hydrogen therapy – a review of clinical studies.
Medical Gas Research
Molekylärt väte (H₂) har de senaste åren uppmärksammats för sina potentiella medicinska egenskaper, särskilt inom områden som inflammation och smärtlindring. Genom sina unika antioxidativa och antiinflammatoriska effekter erbjuder väte ett innovativt tillvägagångssätt för lokal behandling av smärttillstånd [1].
Mekanismer
Vätet verkar främst genom att selektivt neutralisera skadliga reaktiva syreföreningar (ROS), såsom hydroxilradikaler, samtidigt som det minskar uttrycket av inflammatoriska mediatorer [2]. Detta sker bland annat genom modulation av signalvägar såsom NF-κB, vilket leder till nedsatt inflammatorisk respons [3].
Lokal Applicering
Topikal applicering av väte, till exempel via väteberikade geler eller bad, har visat positiva effekter i djurstudier. Zhu et al. rapporterade att väteberikad saltlösning främjade läkning och reducerade smärta hos diabetiska möss genom att minska oxidativ stress [4]. Liknande resultat observerades i en studie av Xie et al., där vätehaltigt vatten lindrade neuropatisk smärta [5].
Klinisk Tillämpning
Inom idrottsmedicin har väte använts för att reducera muskeltrötthet och inflammatoriska responser efter fysisk ansträngning [6]. Även vid reumatoid artrit har dess fördelar dokumenterats [7].
Framtida Perspektiv
Trots lovande resultat krävs fler randomiserade kliniska studier på människor för att fastställa standardiserade behandlingsprotokoll och doser.
H2 Clinic i Cork, Irland
H2 Clinic grundades 2018 av Noel O’Connor, specialist i behandling av ryggsmärtor under de senaste 33 åren på Kilross Clinic i Bishopstown, Cork (8).
Noel säger: Efter att ha forskat kring teorin och den kliniska tillämpningen av väteterapi för tillstånd som reumatoid artrit, artros, neuropatisk smärta och många andra besvär som inte svarat på annan behandling, har molekylärt väte visat sig vara ett mycket säkert och effektivt behandlingsalternativ.
Det är den första kliniken i sitt slag som använder molekylärt väte för smärtlindring.
Noel Connor fortsätter: Det finns en rad olika metoder för att administrera väte för terapeutiska ändamål, de vanligaste är vätediffusion i vatten och inhalation via näskateter eller lokal applicering.
H2-intag eller -applikation är effektivt inom tio minuter i kroppen och på grund av sin lilla storlek kan molekylärt väte enkelt penetrera och diffundera genom cellmembranet, vilket gör det högst biodisponibelt.
De multidimensionella fördelarna med väte har visat sig reducera smärta, främja hjärnhälsa, stödja frisk åldrande och livslängd samt påverka skaderehabilitering positivt. På H2 Clinic i Bishopstown, Cork administrerar vi vätgas med högvolymsvätegeneratorer för bästa terapeutiska resultat.
Kontakta oss gärna för att få reda på hur man praktiskt går tillväga!
Referenser
Artikelns innehåll är avsedd för informationsändamål och ersätter inte medicinsk rådgivning.
Cellernas energiproduktion bygger på att kemisk energi i näringsämnen omvandlas till ATP via glykolys, citronsyracykeln och oxidativ fosforylering. En central princip i all bioenergetik är att energin till stor del bärs av väte – i form av hydridjoner (H⁻) som överförs till NAD⁺ och FAD, samt i form av protoner (H⁺) som driver ATP-syntesen. Reduktionskraften i NADH och FADH₂ fungerar som ”energipaket” av väte som levereras till elektrontransportkedjan (ETC), där elektronerna avges och protonerna bidrar till den elektrokemiska gradient som krävs för ATP-produktion [1,7].
I glykolysen överförs väte från glukos till NAD⁺ och bildar NADH, som sedan avger sitt väte i mitokondrierna [1]. I citronsyracykeln frigörs ytterligare stora mängder väte genom oxidativa dehydrogeneringsreaktioner katalyserade av NAD⁺-beroende dehydrogenaser [10]. Det är dessa vätebärande koenzymer som i ETC möjliggör protonpumpning över det inre mitokondriemembranet och därmed skapar den protonmotordrivande kraft som ATP-syntas kräver [6].
Väte är därmed centralt i två av energimetabolismens mest fundamentala processer: elektronöverföring och protongradientens uppbyggnad. Varje NADH bär två elektroner och ett hydridjoniskt väte som i kedjan separeras till elektronflöde och protonflöde; detta gör väte till den primära molekylära bäraren av kemisk energi i aerob metabolism [7].
Utöver sin roll i energiproduktion är väte avgörande i cellens redoxbalans och antioxidantförsvar. Ett centralt exempel är superoxiddismutas (SOD), som omvandlar superoxidradikaler (O₂•⁻) till väteperoxid (H₂O₂). För att SOD ska upprätthålla sin aktivitet krävs att dess metallcentrum (Cu/Zn eller Mn beroende på isoform) hålls i korrekt redoxstatus. Detta förutsätter tillgång till ett reducerande system där vätebärande molekyler som NADPH fungerar som elektron- och vätekälla via redoxcykler [3,4].
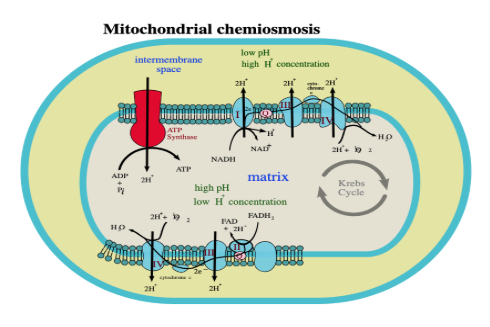
Bilden visar hur H⁺-gradienten driver ATP-syntes, alltså kopplingen mellan vätejonflödet och energiproduktion enligt Mitchells kemiosmotiska teori, samt sambandet NADH → protonpumpning → ATP [2,6].
NADPH genereras främst i pentosfosfatvägen och används för att regenerera reducerade former av flera antioxidativa enzymer. I praktiken innebär detta att väte i form av reduktionskraft är nödvändigt för att SOD ska kunna återställas indirekt genom samverkan med glutathion- och thioredoxinsystemen, som kräver NADPH som elektron- och vätedonator [4].
Dessutom har molekylärt väte (H₂) visats kunna neutralisera hydroxylradikaler och peroxynitrit och därigenom minska oxidativ stress [9]. Även om detta inte är huvudmekanismen för SOD-reduktion, utgör det ytterligare ett exempel på väte som en biologiskt aktiv redoxmodulator.
Väte är därmed en grundläggande komponent i cellens bioenergetik och antioxidantförsvar. I energiproduktionen bär väte den reduktiva kraft som driver elektrontransportkedjan och ATP-syntesen [6,7]. I antioxidativ metabolism fungerar väte, i form av NADPH-buren reduktionskraft, som nödvändig komponent för att återställa SOD och andra nyckelenzymer i cellens skydd mot oxidativ stress [3,4]. Detta gör väte till en central nod i kopplingen mellan energiomsättning, redoxbalans och cellulär homeostas
Referenser
[1] Berg, J. M., Tymoczko, J. L., & Gatto, G. J. (2015). Stryer’s Biochemistry (8th ed.). W.H. Freeman.
Förlagssida: https://www.macmillanlearning.com/college/us/product/Stryer-s-Biochemistry/p/146412610X
[2] Boyer, P. D. (1997). The ATP synthase—A splendid molecular machine. Annual Review of Biochemistry, 66, 717–749.
DOI / förlagssida: https://doi.org/10.1146/annurev.biochem.66.1.717
[3] Fridovich, I. (1995). Superoxide radical and superoxide dismutases. Annual Review of Biochemistry, 64, 97–112.
DOI / PubMed: https://pubmed.ncbi.nlm.nih.gov/7574505/
[4] Halliwell, B., & Gutteridge, J. M. C. (2015). Free Radicals in Biology and Medicine (5th ed.). Oxford University Press.
Förlagssida: https://global.oup.com/academic/product/free-radicals-in-biology-and-medicine-9780198717478
[5] Hardie, D. G. (2014). AMPK—A key regulator of energy balance. Current Biology, 24(17), R108–R114.
DOI / PubMed: https://pubmed.ncbi.nlm.nih.gov/25247363/
[6] Mitchell, P. (1961). Coupling of phosphorylation to electron and hydrogen transfer by a chemiosmotic mechanism. Nature, 191, 144–148.
DOI / Nature: https://doi.org/10.1038/191144a0
[7] Nicholls, D. G., & Ferguson, S. J. (2013). Bioenergetics 4. Academic Press.
Förlagssida: https://www.elsevier.com/books/bioenergetics-4/nicholls/978-0-12-388425-1
[8] Nelson, D. L., & Cox, M. M. (2021). Lehninger Principles of Biochemistry (8th ed.). W.H. Freeman.
Förlagssida: https://www.macmillanlearning.com/college/us/product/Lehninger-Principles-of-Biochemistry/p/131922800X
[9] Ohsawa, I., et al. (2007). Hydrogen acts as a therapeutic antioxidant by selectively reducing hydroxyl radicals. Nature Medicine, 13(6), 688–694.
DOI / PubMed: https://pubmed.ncbi.nlm.nih.gov/17486089/
[10] Stryer, L., Berg, J. M., & Tymoczko, J. L. (2019). Biochemistry (9th ed.). W.H. Freeman.
Förlagssida: https://www.macmillanlearning.com/college/us/product/Biochemistry/p/1319114659
frågor och svar om kostfiber...
Kostfibrer är delar av växtbaserade livsmedel som inte bryts ner i matsmältningen. De passerar relativt intakta genom magen och tarmen och har flera viktiga funktioner i kroppen.
Det finns två huvudtyper: lösliga fibrer (som finns i t.ex. havre, frukt och baljväxter) och olösliga fibrer (som finns i fullkorn, grönsaker och vetekli). Båda är viktiga för hälsan.
Lösliga fibrer kan sänka kolesterolnivåerna, hjälpa till att kontrollera blodsockret och ge en känsla av mättnad. De omvandlas också till kortkedjiga fettsyror i tarmen som gynnar tarmhälsan.
Olösliga fibrer ökar volymen på avföringen och underlättar passagen genom tarmen, vilket minskar risken för förstoppning och bidrar till en välfungerande tarm. Troligen bryter kroppen ned mer och mer av olösliga fibrer när bakteriefloran i tarmen ökar och diversifieras.
Fibrer bidrar till god tarmfunktion, minskar risken för hjärt- och kärlsjukdomar, typ 2-diabetes och vissa cancerformer. De kan också hjälpa till med viktkontroll eftersom man blir mätt under en lägre tidsperiod efter en måltid.
Livsmedelsverket rekommenderar minst 25–35 gram kostfibrer per dag för vuxna. Många i Sverige får i sig betydligt mindre än det. Troligen är detta en för låg siffra många forskare talar om 50 g per dag som önskvärt. Hadzafolket i Tanzania som inte har några västerländska sjukdomar äter 100-150 g per dag.
Fullkornsprodukter (som rågbröd och havregryn), frukt, grönsaker, baljväxter (linser, bönor) och nötter är alla fiber- och näringsrika alternativ.
För lite fibrer leder till förstoppning, obalans i tarmfloran och ökad risk för övervikt, hjärt-kärlsjukdomar och typ 2-diabetes.
Ja, ett mycket högt fiberintag – särskilt om det sker plötsligt – kan ge gaser, uppblåsthet och magbesvär. Det är bäst att öka fiberintaget gradvis och dricka mycket vatten. Vissa av dessa gaser är betydelsefulla för kroppens ämnesomsättning och detta börjar mer och mer uppmärksammas av forskare.
Byt till fullkornsprodukter, ät mer frukt och grönsaker med skal, lägg till baljväxter i maten och välj fiberrika snacks som nötter eller frön. Det kan vara svårt att få i sig tillräcklig mängd via kosten och då kan ett allstidigt kosttillskott som Raw Fiber vara bra.
Ja, det är en ny svensk studie visar att en kost med lite fibrer och mycket rött kött kraftigt ökar risken för att utveckla farliga plack i hjärtats kranskärl – förändringar som kan leda till hjärtinfarkt eller plötslig död. Inger Larsson och hennes medarbetar har följt över 24 000 personer och visar att personer med en ”inflammatorisk kost” hade fler och farligare plack jämfört med dem som åt mer växtbaserat. De hade också högre blodtryck, större midjemått och sämre blodfetter – alla riskfaktorer för hjärt-kärlsjukdom.
Du kan läsa hela studien här: Low-fibre diet is associated with high-risk coronary plaque features, Cardiovascular Research, 2025
frågor och svar om vätgasterapi...
Det innebär att man andas in en blandning av molekylärt vätgas (H₂), ofta tillsammans med syre eller luft, via en slang, näsgrimma eller mask. Syftet är att ta upp vätgas samt syrgasen genom lungorna.
Studier har visat att vätgas kan fungera som en selektiv antioxidant, minska oxidativ stress och inflammation samt förbättra mitokondriell funktion. Den har testats vid tillstånd som hjärt-kärlsjukdom, stroke, cancer, KOL, covid-19, Parkinson och trötthet.
Vätgas (H₂) är en mycket liten molekyl som snabbt sprider sig i kroppen. Den kan neutralisera skadliga fria syreradikaler (främst hydroxylradikaler), och påverkar också genuttryck och signalvägar kopplade till inflammation och cellskydd.
Ja, särskilt från Japan, Kina och Sydkorea, över 2 000 vetenskapliga artiklar har publicerats. De flesta är prekliniska (djur, celler), men ett ökande antal kliniska studier visar positiva effekter vid bl.a. hjärtinfarkt, metabolt syndrom, covid-19 och neurodegenerativa sjukdomar.
Ja, enligt befintlig forskning är vätgasinhalering mycket säker i terapeutiska koncentrationer (ofta 1–4 % vätgas i luft). Vätgas är inte giftigt och kroppen producerar 1-2 liter per dygn naturligt via tarmfloran. Troligen är den naturliga produktionen av vätgas och andra gaser i tarmen mycket större hos människor som äter en fiberrik kost.
Typisk behandlingstid varierar från 20 minuter till 1–2 timmar, en eller flera gånger dagligen. Effekt och behov kan variera beroende på hälsotillstånd och syfte (akut behandling eller långsiktig hälsostöd). Kan vara mycket längre vid olika sjukdomstillstånd.
Inhalering ger snabbare och högre koncentrationer i blodet och vävnader. Vatten med löst vätgas är praktiskt men ger betydligt mindre mängd – ofta 0,1–0,3 mmol per glas jämfört med >20 mmol vid inhalering.
Ja, vi säljer vätgas/syrgasgeneratorer för hemmabruk, men det är viktigt att använda enheten enligt våra instruktioner och tänka på att en viss brandrisk förekommer. Man bör ha bra ventilation och inte ha tända stearinljus i närheten. Vissa smärtläkare har börjat använda ren vätgas lokalt och då bör man inte ha kläder som ger upphov till statisk elektricitet.
I vissa länder (t.ex. Kina) används vätgasinhalering redan i klinisk vård, t.ex. för covid-19, astma och kol, samt som tilläggsbehandling vid cancer. I EU och Sverige är det ännu inte godkänt som läkemedel men används inom friskvård och studeras i kliniska försök.
Det finns få kända kontraindikationer, men personer med mycket känsliga luftvägar, grav astma, gravida eller under särskild medicinsk behandling bör inte inhalera ren vätgas. Vi rekommenderar att man alltid andas in både vätgasen och syrgasen som kommer från maskinen, då får kroppen hela tiden tillräckligt med syrgas, och alla kan inhalera. Man använder vätgas/syrgasinhalation vid behandling av t ex astma och kol.
Oftast räcker 1-2 timmar per gång, men vid svårartade tillstånd kan man med fördel sova under inhalation, dvs 8-10 timmar per dag. I Kina är detta en rekommendation vid postcovid tillsammans med annan behandling. Vid behandling av olika tumörsjukdomar kompletterar man I Kina cellgiftsbehandling och/eller strålning med vätgas/syrgas inhalation 1-3 timmar per dag. Man har då också sett mindre biverkningar av cancerbehandlingen. Efter det att behandlingen är slutförd fortsätter man med inhalationen för att minska risken för återfall.
Detta är en vanlig fråga. Anledningen till att vätgasterapi inte är lika känd är att H₂ inte kan patenteras, vilket innebär att det inte kan omvandlas till ett läkemedel.
Dessutom har vätgas en kort halveringstid (cirka 60 minuter), vilket gör den omöjlig att lagra och sälja kommersiellt som en färdig produkt.
Men när det gäller antioxidanter och antiinflammatoriska ämnen, är H₂ ett av de mest effektiva ämnen vi känner till. Eftersom det naturligt kan tränga in i alla kroppens celler och organ, ger det en kraftfull och djupgående effekt som är svår att uppnå med andra antioxidanter.